- Kayan filamentler teorisinin yayınlanmasından bu yana, kas kasılmasının moleküler mekanizmalarının aydınlatılmasında dikkate değer bir ilerleme kaydedilmiştir.
- Bu gelişmeye rağmen, kas fonksiyonunun çeşitli özelliklerine ilişkin açıklamalar yetersiz kalmıştır.
- Bunları açıklamaya yönelik çabalar, alternatif hipotezlerin yanı sıra orijinal teorinin modifikasyonlarına da yol açmıştır.
- Nishikawa ve arkadaşları kayan filamentler teorisine yeni bir ekleme önermektedir: kas sarkomerlerinin iki aşamalı Winding Filament Modeli.
- Winding filament modeli ile kayan filamentler teorisinin yerini alması amaçlanmamıştır.
- Bunun yerine, Ca++ akışı ve çapraz köprü döngüsüyle modüle edilen, aktif kas sarkomerinde elastik eleman olan titini ekleyen winding filament modeli, kayan filamentler teorisi altında problemli kalan bazı fenomenleri açıklamayı hedefler.
Kayan Filamentler Teorisi Nedir?
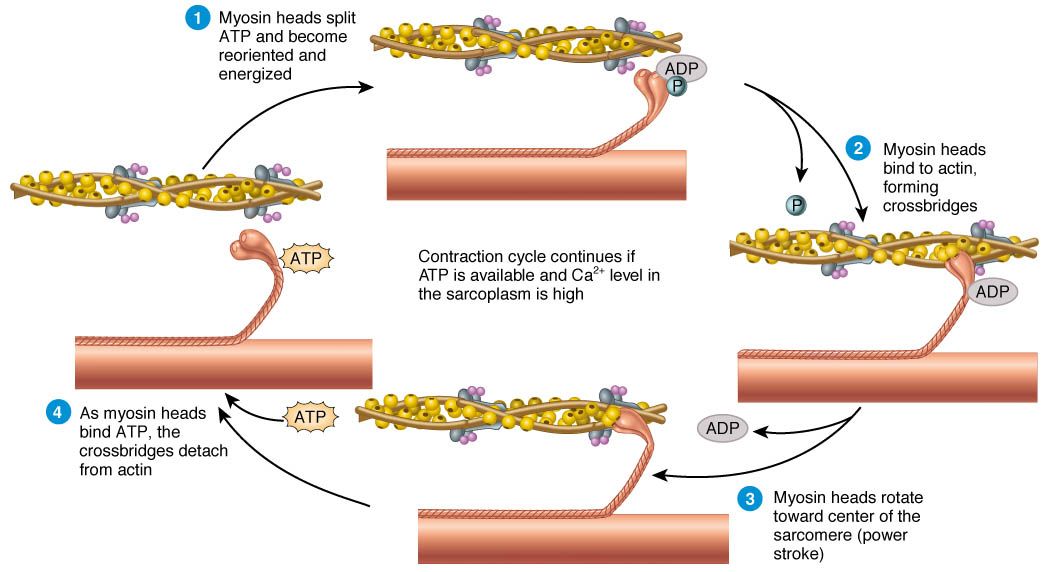
Bu teori ince filamentlerin miyozin üzerindeki kayma hareketinden bahseder. Bu kayma hareketi döngüsü şu şekildedir:
- Aktine bağlanmadan önce Miyozin başı, ATP’yi, ADP ve inorganik fosfata (Pi) ayırır. Miyozin bağlanınca, aktin-miyozin-ADP-Pi kompleksi oluşur.
- Miyozin başları ilk bağlanmada 90 derecelik açı yapmaktadır.
- İnorganik fosfat miyozin başından ayrıldığında miyozin başının boyunla yaptığı açı 90 dereceden 50 dereceye düşer. Böylece, aktin ve miyozin filamentleri birbirleri üzerinden kayar (power stroke veya güç vurumu)
- Daha sonra miyozin başından ADP ayrılınca da açı 45 dereceye düşer ve kayma işlemi sonlanır.
Filamentlerin birbiri üzerinde kayması sonucu;
- İki Z çizgisi birbirine yaklaşır ve sarkomerin boyu kısalır.
- H ve I bandlarının boyu kısalırken, A bandının boyu değişmez.
- Aktin-miyozin kompleksi yeni bir ATP molekülü miyozin başına bağlanıncaya kadar 45 derecelik açı ile değişmeden kalır. ATP bağlanması ile miyozin başı, aktinden yavaşça ayrılır. Buna ATP’nin yumuşatıcı yada gevşetici etkisi denir.
Titin’in Yapısı ve Fonksiyonu
- Bilinen en büyük proteinlerdendir.
- İpliksi yapıda olduğu için çok esnektir.
- Bu esnek titin molekülleri miyozin ve aktin iplikçiklerini yerlerinde tutan bir iskelet görevi görmektedir. Sarkomerin kasılma mekanizması bu sayede işleyecektir.
- Titin molekülünün bir ucu elastiktir ve Z diskine bağlıdır; sarkomer kasılıp gevşerken yay gibi davranarak boyunu değiştirir.
- Titin molekülünün diğer ucu miyozin kalın iplikçiklerine bağlıdır.
- Bilinen en büyük protein olan titin, çizgili kaslarda en fazla bulunan üçüncü protein olmasına rağmen , keşfedilen son kas proteinlerinden biridir.
- Titin benzeri liflerin varlığı erken yapısal çalışmalarda ortaya çıkmasına rağmen, titin kayan filamentler teorisinin gelişmesinden 20 yılı aşkın bir süre sonra keşfedilmiştir.
- Bu nedenle kayan filamentler teorisinin gelişimi titin göz önüne alınmadan devam etmiştir.
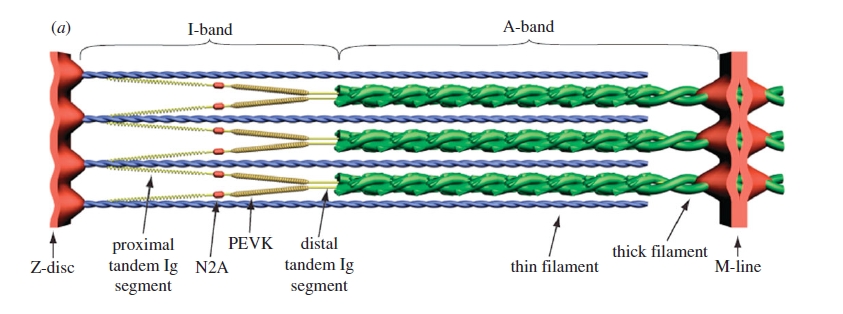
- Titin, Z-diskten M-çizgisine kadar tüm yarım sarkomere yayılmaktadır.
- Hem Z-disklerinde hem de M-hatlarında titin moleküllerinin üst üste gelmesi, bir kas lifinin tüm uzunluğu boyunca sürekli olan bir titin filament sistemi üretir.
- Erken titin çalışmaları sarkomer bütünlüğünü sağlamada rol oynamış ve pasif gerime katkıda bulunmuştur.
- Şu anki çalışma, myofibrillar tertibatının ve hücre sinyallemesinin düzenlenmesinde titinin rollerine odaklanmaktadır.
Winding Filament Hipotezi
- Bu model hipotez ince filamentin miyozin üzerinde kayma hareketine ilave olarak, ince filamentin rotasyona uğradığını varsayar.
- Titin, A bandında kalın filamentlere ve Z diskindeki ince filamentlere bağlandığından, ince filamentlerin çapraz köprüler tarafından rotasyona uğratılması, kaçınılmaz olarak bunların üzerine titinin sarılmasına yol açmalıdır.
- İnce filamentlerin çapraz köprüler tarafından rotasyonu, ayrıca Z-diskinde α-aktininde bir tork üretecektir.
- İnce filamentler üzerinde titin sarmalı, PEVK’nin uzunluğunu ve sertliğini değiştirmesi, izometrik kas kasılması ve aktif gerilme sırasında elastik potansiyel enerjiyi depolaması beklenmektedir.
- Aktif kısalma sırasında bu enerji geri kazanılabilir.
Ca++ Aktivasyonu Üzerine Titinlerin Mekanik Etkileşimi
- Ca++ un ince filamentlere bağlanmasıyla titin, titin sertliğinin modülasyonu için ideal bir konumdadır.
- Titinin aktine bağlanması, normal olarak, uzun süre myofibrillerin pasif esnemesi üzerine meydana gelen I-bandındaki proksimal tandem Ig alanlarının düşük-kuvvetli düzleşmesini ortadan kaldıracaktır.
- Ayrıca, Ca2 + ile aktive edilmiş sarkomerlerin gerilmesi durumunda, PEVK segmenti yüksek kuvvette uzar.
- Eğer titin ve ince filamentler arasında Ca2 bağlantısı önlenebilirse, kısa sarkomer uzunluklarında aktif kuvvet üretimi azalır, çünkü titinde geliştirilen herhangi bir gerginlik, daha yüksek kuvvetle PEVK segmentini uzatmak yerine düşük kuvvette tandem Ig segmentlerini düzleştirecektir.
- Böylece, titinin toplam aktif kuvvete katkısı azalacaktır.
İnce Filament Rotasyonu ve Titin Sarmalı
- Aktif kas sarkomerlerinde, çapraz köprüler ince filamentleri translasyona uğrattığı gibi rotasyona da uğratır.
- Kalın ve ince filamentlerin yapısı göz önüne alındığında, bir aktin monomer ve onun üç komşu kalın filamentleri arasındaki stereospesifik bağın korunması için, ince filamentlerin, miyosin başları tarafından bir aktin monomer uzunluğu (5.5 nm) translasyonu ile 28 derece rotasyona uğraması gerekir.
- Bu, her 71,5 nm’lik translasyon için ince filamanların tam bir rotasyonu demektir.
Pasif Gerilme Sırasında İskelet Kası Sarkomerindeki Değişiklikler
- En üstte; Proksimal tandem Ig bölgeleri turuncu, PEVK segmenti yeşil ile gösterilen gevşek bir sarkomer gösterilmiştir.
- Ortada; Sarkomer pasif olarak gerildiğinde ilk olarak gerilme, proksimal tandemde gerçekleşir.
- En altta; Proksimal tandem eşik gerginliğine ulaştıktan sonra PEVK segmenti gerilir.
Aktif Gerilme Sırasında Kas Sarkomerindeki Değişiklikler
- Aktif kasta titin proteini N2A bölgesinden (kırmızı nokta) ince filamente tutunur.
- Aktif kasta gerilme gerçekleşirken proksimal tandemde herhangi bir hareket olmaz, yalnız PEVK bölgesi gerilir.
- PEVK segmenti yapısı gereği proksimal tandeme oranla daha serttir ve PEVK segmentindeki gerilme sırasında toplanan elastik potansiyel enerji miktarı çok daha fazladır.
Sonuç
- Winding filament modeli, titinin PEVK segmentinin kas gücü gelişimine ve aktif kısalmaya katkıda bulunduğu basit bir mekanizma sağlar.
- Genel olarak kas sarkomerlerinin ve özellikle titinin yapısal ve viskoelastik özellikleri ile tutarlıdır.
- Kayan filamentler teorisine dayanır ve bu teorinin açıklayıcı gücünü arttırır.
- Winding filament modelinde, N2A’nın ince filamanlara Ca++ bağlanması, gevşek uzunlukta iskelet miyofibrillerinin pasif gerilmesi üzerine oluşan I-bandındaki proksimal tandem Ig alanlarının düşük kuvvetle düzleşmesini önler.
- Bu şekilde iskelet kasındaki orta sarkomer uzunluklarında kuvvet ve hızdaki platoya katkıda bulunur.
- Winding filament modelinde, çapraz filamentlerin her bir ATP hidroliz döngüsünde, ince filamentler üzerinde PEVK sarmalı oluşur.
- Bu sarmal izometrik kuvvet gelişimi sırasında PEVK’de elastik enerji depolar.
- Depolanan enerji, harici yüke bağlı oranlarda kısalma sırasında geri kazanılır.
- Ayrıca mevcut kanıtlar, eksantrik kasılma sırasında tortusal kuvvet arttınlmasının, titin aktivasyonundan kaynaklandığını, bunun, deaktivasyondan sonra da devam ettiğini göstermektedir.
Kaynaklar:
- Kiisa C. Nishikawa1,*, Jenna A. Monroy1, Theodore E. Uyeno2, Sang Hoon Yeo3, Dinesh K. Pai3 and Stan L. Lindstedt1 – 2012 – Is titin a ‘winding filament’? A new twist on muscle contraction.
- Jenna A. Monroy1, Krysta L. Powers1, Leslie A. Gilmore1, Theodore A. Uyeno2, Stan L. Lindstedt1, and Kiisa C. Nishikawa1 – 2012 – What Is the Role of Titin in Active Muscle?
- Kiisa Nishikawa* – 2016 – Eccentric contraction: unraveling mechanisms of force enhancement and energy conservation
- John E. Hall – Guyton Tıbbi Fizyoloji